2019年12月30日,国际著名期刊PNAS在线发表了我校3044am永利集团欢迎您•整合3044am永利集团欢迎您朱家鹏教授团队的最新研究成果Structure of the Cytochrome aa3-600 Heme-copper Menaquinol Oxidase Bound to Inhibitor HQNO Shows TM0 Is Part of the Quinol Binding Site。朱家鹏教授为该论文通讯作者,朱教授团队硕士研究生徐晶晶、青年教师刘冰和美国University of Illinois at Urbana-Champaign丁子桥博士为共同第一作者。
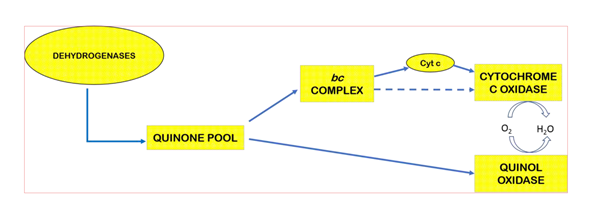
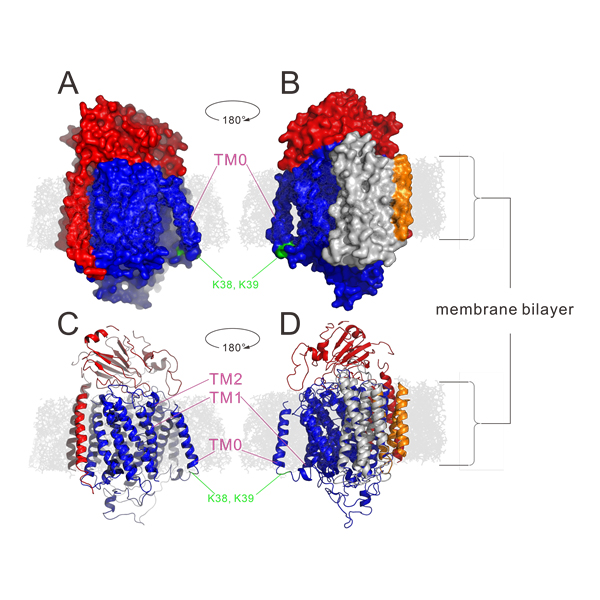
在生物细胞内的氧化过程中,呼吸链的最后一个酶将氧气还原成水,同时向胞外泵出质子、形成跨膜质子梯度以驱动ATP产生。大多数这样的酶,例如线粒体中的细胞色素c氧化酶,接受被bc1 complex还原的细胞色素c(cyt c)的电子将氧气还原成水。但在细菌中,有一类被认为从细胞色素c氧化酶进化而来的Quinol Oxidase能直接接受还原态醌醇(甲萘酚menaquinol或泛醌ubiquinol)的电子、将氧气还原成水(图1)。朱家鹏教授团队与美国University of Illinois at Urbana-Champaign 生物化学系Robert Gennis课题组合作,解析了枯草芽孢杆菌中Menaquinol Oxidase 3.6Å分辨率的蛋白晶体结构,并揭示了此类酶的催化结构特征。研究发现:Menaquinol Oxidase的Subunit I第一个跨膜螺旋区TM0形成的结构域可促进催化底物与酶的结合(图);揭示了Menaquinol Oxidase的催化中心位置,以及活性中心氨基酸残基与底物的相互作用方式。蛋白结构与其功能密切相关,对Menaquinol Oxidase晶体结构的解析将促进我们更好的理解这类Quinol Oxidase的工作机理。
该研究获得中西医结合优势学科建设项目专项经费、国家重点研发计划精准医学研究专项基金,江苏省双创团队基金和江苏省特聘教授基金等项目的资助。
论文链接:
https://www.pnas.org/content/early/2019/12/26/1915013117
https://doi.org/10.1073/pnas.1915013117